Проведена первая в истории персонализированная генная терапия
Тихо и без всякой помпы человечество шагнуло в эру персональной генной терапии — это когда под конкретного пациента разрабатывается индивидуальный план лечения.
Первый таким человеком стал KJ – ребёнок с редчайшим заболеванием дефицита карбамоилфосфатсинтетазы 1-го типа. Заболевание действительно крайне редкое, встречается меньше, чем в раз на миллион. Из-за поломок в гене CPS1 (carbamoyl-phosphate synthase 1) нарушается цикл синтеза фермента карбамоилфосфатсинтетаза 1, из-за чего в организме человека начинает накапливаться аммиак, не выводимый с мочой. Если не повезло и болезнь проявилась сразу же после рождения, это достаточно быстро приводит к тяжёлым осложнениям, вплоть до летального исхода. Хотя диетой, приёмом специальных препаратов и гемодиализом, можно продлить жизнь (особенно если заболевания проявилось позже), срок жизни таких людей сильно ограничен. Единственный надёжный вариант — это пересадка печени, но с ней связаны свои риски, да и пересадка возможна только в достаточно взрослом возрасте при наличии донора.
И вот теперь у таких пациентов появился шанс на лечение, причём сразу в детстве. Группа учёных из Детской больницы Филадельфии и Penn Medicine, академического медицинского центра, провели первую в истории человечества генетическое редактирование гена CPS1. Причём в отличии от других подобных случаев, здесь терапия была разработана таргетно. Было проведено секвенирование ДНК и точно определены участки гена с ошибкой.
Для редактирования была применена стандартная технология CRISPR/Cas9. В липидные наночастицы был помещён лечебный комплекс, благодаря чему удалось отредактировать нужные клетки.
Всего KJ получил 3 инфузии — в конце февраля 2025 года, а затем в марте и апреле этого же года. Каких-либо серьёзных побочных эффектов не наблюдалось, а вот состояние пациента значительно улучшилось. Ребёнок смог усваивать куда большее количество белка, а поглотителей азота в виде лекарств потребовалось меньше. Кроме того, улучшилось и общее состояние: в частности, KJ смог переболеть риновирусом без сильного повышения аммиака.
Теперь ребёнку предстоит длительный этап наблюдения — требуется убедиться, что лечение подействовало на достаточное количество клеток печени, чтобы он мог жить без поддерживающей терапии.
Новость, без сомнения, интересная, но пока это больше мечты о медицине, какой она должна быть. Разработка конкретной терапии потребовала месяцев работы высококлассных специалистов и проводилась на гранты государства. И это исключая десятилетия предварительной работы. Если бы речь шла исключительно о коммерческой деятельности, сумма составила бы десятки миллионов долларов. Обычной средней семье это не по карману, разумеется.
Впрочем, есть и хорошие новости. Впервые разные генные терапии начали одобряться к 2023 году, и сейчас медицина способна значительно облегчить (а то и вылечить) несколько генетических заболеваний. Стоит, правда, такое удовольствие недёшево, около 2 млн. долларов, но уже появляются инициативы, которые должны радикально уменьшить (раз эдак в 10) её стоимость в ближайшие лет 5-7.
В общем, обычный процесс выхода лекарства в широкий доступ. Сначала как наука, потом как очень дорогое лекарство, а потом доступно всем.
P.S. Ещё у меня есть бессмысленные и беспощадные ТГ-каналы (ну а как без них?):
Вот тут про молекулярную биологию, биотех и новых исследованиях: https://t.me/nextmedi;
Мой личный, куда сваливается наука и всякое гиковское: https://t.me/deeplabscience.



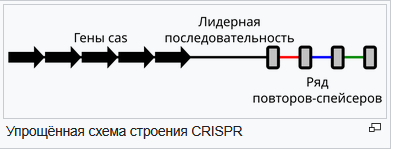
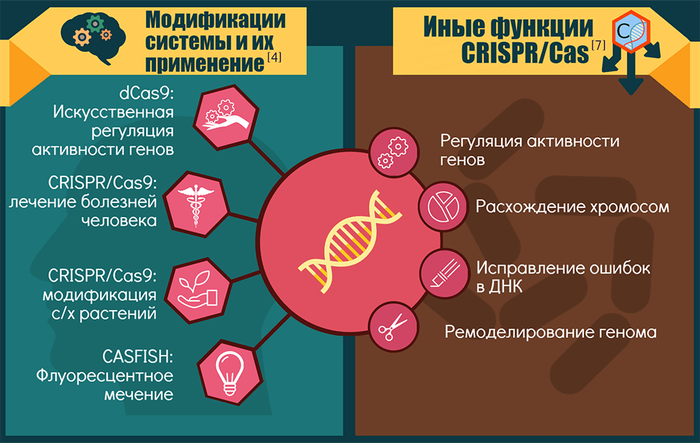










![CRISPR/Cas9 [научный фотоконкурс] Научный фотоконкурс, Crispr-cas9, Биохимия, Длиннопост](https://cs13.pikabu.ru/post_img/2020/12/07/0/1607289149140475731.jpg)
![CRISPR/Cas9 [научный фотоконкурс] Научный фотоконкурс, Crispr-cas9, Биохимия, Длиннопост](https://cs13.pikabu.ru/post_img/2020/12/07/0/1607289173115256580.jpg)
![CRISPR/Cas9 [научный фотоконкурс] Научный фотоконкурс, Crispr-cas9, Биохимия, Длиннопост](https://cs10.pikabu.ru/post_img/2020/12/07/0/160728929414548059.jpg)