Приветствую!
В предыдущей части мы одним глазком посмотрели на испытательное оборудование, используемое в лаборатории органического синтеза. Точнее, на ту его малую часть, которую используем мы. Сегодня мы поговорим о хроматографическом оборудовании. Этот пост я пилил долго, т.к. хроматографию очень уважаю и хотел сделать пост максимально информативным, и при этом понятным.
Хроматография давно перестала быть рядовым физико-химическим методом анализа. Принцип хроматографического разделения, заключающийся в том, что различные вещества по разному сорбируются\десорбируются на границе раздела фаз, оказался крайне универсальным для создания как аналитических, так и препаративных методов разделения и очистки веществ.
Я не буду перечислять все возможные виды хроматографии, моя цель - рассказать о приборном парке, представляющем хроматографию в синтетической лаборатории. Также я не буду, по крайней мере в этой части, писать про ТСХ и атмосферную хроматографию, так как там о сколько-нибудь серьезном оборудовании речи нет. А расскажу я про ГХ, ВЭЖХ, ГПХ и флеш-хроматографии в применении её к органическому синтезу, синтезу полимеров и исследованию материалов.
Итак, поехали!
1)Газовая хроматография, ГХ. Принцип разделения - сорбция\десорбция из газовой фазы. Чем более летучее и менее сорбирующееся вещество, тем быстрее оно проделает путь по колонке и выйдет наружу - в детектор. В каком-то смысле газовая хроматография есть логическое продолжение идеи ректификации.
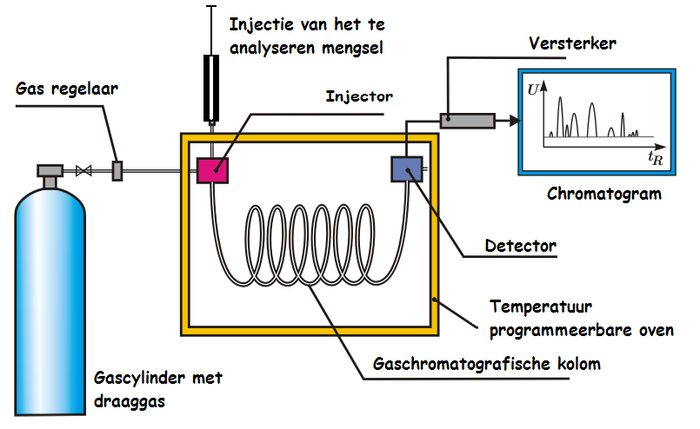
Схема простейшего газового хроматографа. На датском, ну и ладно. Пробы обычно жидкие, поэтому нужен инжекторный порт.
Вот так выглядит навороченный ГХ. С автосамплером и сопряженный с масс-спек детектором.
Стоит баллон гелия\аргона\водорода с редуктором. Газ заходит в хроматограф, на входе - прецизионный регулятор потока, чтобы устанавливать скорость потока газа-носителя через колонку. Далее инжекторный порт - образцы обычно жидкие, и их вкалывают прямо на испаритель. Но при необходимости есть много других способов ввода тведых, жидких и газообразных образцов. Также есть автосамплеры - системы автоматического вкола. Ставишь баночки в штатив, программируешь - а дальше вкалывают роботы, счастлив человек. Есть и более хитрые приблуды, например, для отбора проб из трубопровода и т.д.
На испарителе образец испаряется (часто не весь), доза получившихся паров попадает в колонку. Через колонку с определенной скоростью продувается газ-носитель. При ГХ-разделении ключевую роль играет температура колонки, часто разделение определяется именно температурной программой. Колонка всегда термостатирована! Чаще всего программируют повышение температуры в ходе разделения - по мере нагревания начинают выходить всё более и более тяжелые компоненты. Колонки греют, бывает, и до 400 С.
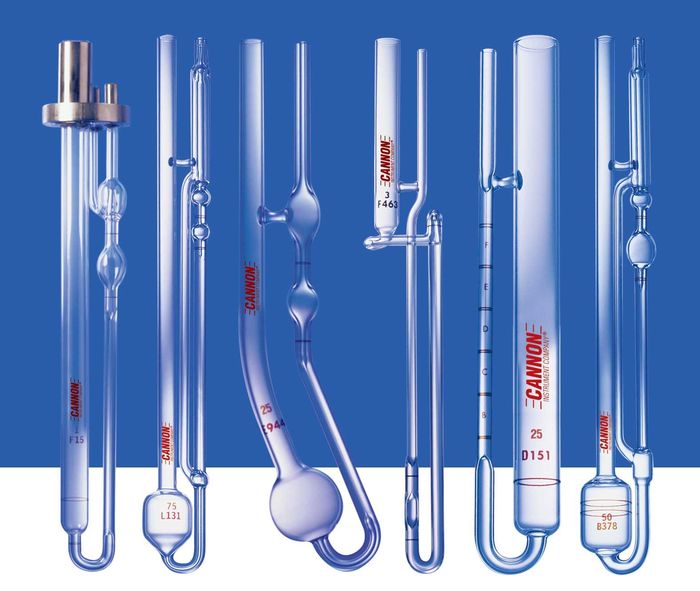
Капиллярная колонка. Реальный диаметр - сантиметров 25. Десятки витков - общая длина колонки может превышать 100 метров!
Колонки для ГХ очень длинные и тонкие. Насадочные колонки, почти не применяющиеся сейчас, составляют несколько метров в длину и несколько миллиметров в сечении, капиллярные - до сотни метров в длину, а в сечении - сотни или даже десятки микрон. Их приходится сворачивать в катушки, как на фото - благо огромное отношение длина\толщина нивелирует негативное влияние изгиба на эффективность разделения.
Колонки заполнены сорбентом, который ГХ-шники предпочитают называть стационарной фазой. Из-за высоких температур разделения сорбенты для ГХ должны быть очень химически стойкие и не способствовать разрушению анализируемых веществ. Обычно это относительно компактные оксиды - кварц, алюмина, различные цеолиты, кроме того часто используются углеводородные и полимерные фазы. Сорбенты бывают инертные - практически не способные к сорбции. В этом случае разделение регулируется температурой и очень похоже на "нано"ректификацию. Сорбирующие фазы делят по селективности - кто-то любит водородные связи, кто-то гидрофобные взаимодействия, а кто-то вообще работает по принципу молекулярных сит (имеет поры, подходящие по размеру к определенным молекулам).
После разделения компоненты смеси поочередно попадают в детектор. Детектором может служить любой прибор, который может дать количественный отклик на изменение состава газовой фазы. Детекторов в ГХ много, все и не упомнишь, расскажу про самые ходовые.
-Пламенно-ионизационный, работает за счет того, что разные газы при горении ионизуются в разной степени. И если при горении пропустить пламя через пластины под напряжением, потечет ток, величина которого зависит от количества и природы ионов в пламени. Плюсы: чувствует всю сгораемую органику, хороший диапазон линейности, дешевый и простой в эксплуатации. Минусы - отсутствие селективности.
-Катарометрический, тупо измеряет теплопроводность. Плюсы - чувствует всё, дешевый и простой. Минусы - неселективен, низкая чувствительность.
-Детектор электронного захвата. Принцип работы сложный, основан на равновесной ионизации образца свободными электронами. Плюсы - высокая чувствительность и линейность, плюс определенная селективность. Минусы - довольно сложный, не универсальный (например, углеводороды он детектирует плохо).
-Масс-спектрометрический. Колонка просто уходит в масс-спектрометр, обычно с ионизацией EI. Про принцип работы сейчас рассказывать не буду. Плюсы - высокая чувствительность, дает информацию о мольмассе и даже строении вещества (по фрагментации). Минусы - дорогой, низкий диапазон линейности, требует дополнительной квалификации, может создавать разрежение на выходе из колонки.
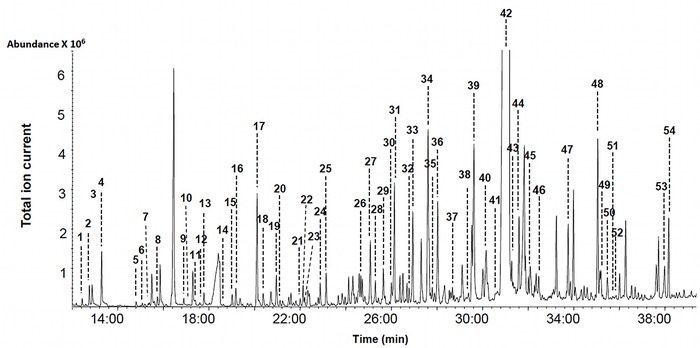
Сигнал детектора записывается с разверткой от времени, которое называют временем выхода Tr - это время, прошедшее от введения смеси в прибор до выхода компонента в детектор.
Хроматограмма ГХ с МС-детектором. Обратите внимание на количество пиков - и все разрешены! 54 компонента БЕЗ учета неидентифицированных.
Очень удобный вариант - двойное детектирование, например, ПИД и МС. ПИД дает количественную картину, а МС идентифицирует состав компонентов.
ГХ (за редким исключением) является исключительно аналитическим методом. Мы используем его в основном для исследования каталитических процессов, намного реже - для исследования кинетики реакций. Иногда определяем состав и примеси в растворителях. Вообще, ГХ очень удобен для потокового анализа и HTS.
Типичный прибор с ПИД и катарометром стоит около 1 млн. р. С МС-детектором - около 2 млн.р. Но это очень приблизительные цифры, разброс цен очень велик.
Плюсы:
1)Дешевизна. Прибор для ГХ может стоить меньше 300К, стоимость расходки также крайне невелика. От оператора не требуется высокой квалификации - экономия на зарплате.
2)От оператора требуется минимум квалификации и телодвижений (естественно, только пока анализ проводится по отработанной методике). У нас ГХ по необходимости делают все - 15-минутный инструктаж, и с прибором справится даже первокурсник.
3)Простота конструкции и дешевизна обслуживания. Это дает возможность при ограниченном финансировании спокойно брать китайские и отечественные приборы. А учитывая, что технологии и конструктив ГХ по сути не меняются уже десятки лет (кроме детектирования) - можно брать и сильно БУ приборы.
4)Высокая чувствительность. Метод позволяет определять пико- и даже субпикограммы. ГХ - наверное, самый чувствительный из доступных методов анализа. Точность тоже хорошая.
5)Широкие возможности интеграции и автоматизации. Но это скорее для промышленности.
Минусы:
1)Главный минус - анализирует только то, что можно испарить. Причем испарить при атмосферном давлении и температурах не выше 400-500 градусов. Это очень, очень сильно ограничивает спектр определяемых веществ. Немного расширить круг субстратов помогает дериватизация - химическое превращение аналита в более стабильную и\или летучую форму. Но именно немного, проблему это не решает. К тому же дериватизация сложных смесей - вещь непредсказуемая.
2)Малые объемы проб закрывают возможность препаративного (т.е. для того, чтобы разделить осязаемы количества и собрать их) использования метода. Раньше на больших насадочных колонках делали преп-ГХ, но разрешение у этих колонок - курам на смех, а возни много. Сейчас то же самое в 99% случаев проще поделить на ВЭЖХ.
3)Непредсказуемость химического поведения веществ. В условиях ГХ (высокая температура, сорбенты) часто происходит разложение, и, что ещё хуже, превращение веществ в другие. А потом сидишь, думаешь - то ли вещества в смеси нет, то ли оно просто сдохло. И ведь главное -стабильность вещества может определяться отсутствием или наличием примесей. Вроде есть метод, проверенный и аттестованный. А потом оказалась в образце примесь, которой у авторов метода не было - и всё, прости-прощай.
Когда-то у нашей лаборатории был свой хроматографический зал, с десятком ГХ - было много задач под них. Сейчас у нас стоит один умеренно старый ГХ с ПИД и катарометрическим детекторами. Изначально управлялся программой под Win95, после определенных танцев с бубном заработал под XP. Но сам прибор работает как часы, менять мы его не собираемся.
ВЭЖХ прибор фирмы Agilent. Единственное, чего я не понимаю - нахрена у них колонка горизонтально подвешена (на фото не видно)???
2)Высокоэффективная жидкостная хроматография, ВЭЖХ. Принцип разделения - сорбция\десорбция из жидкостной фазы на твердую. Отличие ВЭЖХ от других видов жидкостной хроматографии - высокое давление (50-200 бар) в магистрали. Это позволяет использовать сорбенты с очень развитой поверхностью и мелкими гранулами, что увеличивает эффективность разделения на порядки. Есть методы с ещё большим давлением - UPLC (до 1000 бар), но по сути это тот же ВЭЖХ.
Простое и наглядное видео, иллюстрирующее процесс хроматографического разделения смеси.
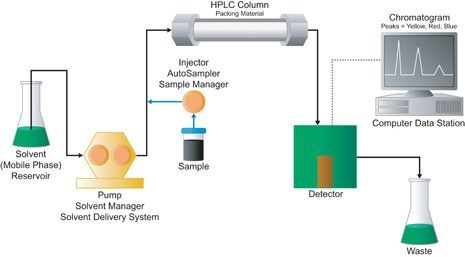
Эта схема справедлива для любой жидкостной хроматографии.
На входе стоят резервуары с растворителями. Они попадают в смеситель и дегазатор, превращаясь в подвижную фазу ака элюент. В жидкостной хроматографии растворитель очень сильно влияет на разделение веществ, поэтому выбор состава элюента очень важен. Широко используемых растворителей для ВЭЖХ около 10 штук, но при необходимости можно использовать и другие. Очень важно, чтобы элюент не был вязким - иначе его невозможно будет прокачать через систему. Для различных детекторов также имеются дополнительные требования к элюентам.
Для смешения растворителей и создания напора применяются разные схемы, но для пользователя это выглядит как несколько каналов (обычно 4), подачу из каждого можно регулировать независимо. Производительность насоса во многом определяет масштаб разделения, доступный на хроматографе.
Дегазирование необходимо потому, что при высоких потоках кавитация (образование пузыриков газа) может вызвать механические повреждения. В первую очередь страдает колонка, т.к. именно в ней происходит понижение давления. Насосы в хроматографах - поршневые, они способны обеспечивать достаточное давление и минимальные пульсации. Тем не менее, после насосов стоит дополнительный гаситель пульсаций давления. Естественно, насосы управляются по величине потока, давление зависит от вязкости элюента и гидродинамического сопротивления системы.
Система ввода Rheodyne. Железяка размером с сардельку (идиотское сравнение, но довольно точное) стоит порядка 50К.
После насоса стоит устройство ввода. Устроено оно сложнее, чем инжекторный порт в ГХ. Обычно это Rheodyne - специальный многоходовой кран высокого давления, снабженный петлей и портом для ввода жидкой пробы. Образец шприцем через порт закачивается в петлю - трубку из стального капилляра, служащую резервуаром. Далее кран поворачивается, и петля оказывается одним концом соединенной с насосом, а другим - с колонкой. Поток элюента вытесняет образец из петли в колонку. Здесь тоже используют автосамплеры. В ВЭЖХ они очень дорогие, могут стоить дороже, чем сам хроматограф.
Выглядят внушительно. Корпус - сталь, резьбовые фитинги.
Колонки для ВЭЖХ совершенно непохожи на ГХ-шные. Корпус из сверхпрочного пластика, нержавеющей стали или даже титана - чтобы держать сотни бар, длина от 10 до 25 см (обычно, бывают и исключения), внутреннее сечение - миллиметры или сантиметры, никаких изгибов. На входе и выходе - титановые сеточки. Для анализа обычно используются колонки с сечением до 2.5 мм. Всё, что толще, так или иначе служит для препаративного разделения.
Сорбентов для ВЭЖХ неисчислимое множество, и выбор сорбента очень важен. Есть три типа стационарной фазы - нормальная, обращенная и специальные. Нормально-фазовые сорбенты - силикагель, алюмина и прочие полярные вещества - элюируют менее полярными элюентами. Более полярные вещества лучше задерживаются на сорбенте. Обратно-фазовые сорбенты гидрофобные вещества, их элюируют водой и элюентами на её основе. Полярные вещества на таких сорбентах задерживаются хуже и выходят первыми. Специальные фазы - это всё, что нельзя однозначно отнести к нормальной или обращенной фазе, в том числе и сорбенты, способные к специфическим взаимодействиям.
У биологов, медиков и аналитиков в ходу обращенная фаза - их объекты обычно полярны. Кроме того, обращенная фаза дает большую эффективность при анализе. Для оргсинтеза чаще всего нужна нормальная фаза - синтезируемые молекулы обычно менее полярны, чаще всего гидрофобны, а порой и разлагаются водой. Специальными фазами пользуются все.
Среди специальных фаз можно выделить фазы для гель-проникающей хроматографии (ГПХ). Её обычно выделяют в отдельный метод, хотя инструментарий для неё ровно тот же. Принцип разделения - по размеру молекул. В сорбенте есть поры определенного размера. Чем меньше молекула, тем дольше она задерживается в порах и, как следствие, медленнее выходит. ГПХ используется в основном для анализа макромолекул.
В ВЭЖХ колонки также принято термостатировать. Обычно делят при температурах от комнатной до 60-70С. Однако при препаративном разделении их часто не термостатируют - эффект температуры невелик.
После колонки разделенные компоненты в виде раствора попадают в детектор. Детекторов в ВЭЖХ тоже немало, расскажу про некоторые:
-Фотометрический детектор. Представляет из себя маленький и сильно упрощенный проточный сепктрофотометр (см. часть 5). Видит любые вещества, поглощающие в видимом диапазоне и ближнем УФ, а это почти вся органика. Плюсы - дешевизна, универсальность, линейность. Минусы - относительно невысокая чувствительность, видит не всё. Требования к элюенту - чтобы не поглощал на измеряемой длине волны. Самый популярный, пожалуй, детектор для ВЭЖХ.
-Флуориметрический детектор. Опять же, маленький и упрощенный спектрофлуориметр. Видит только то, что люминесцирует. Плюсы - чувствительность. Минусы - многое не видит, на интенсивность люминесценции может влиять куча факторов вплоть до микропримесей. Требования к элюенту - не поглощать на волне возбуждения и не содержать люминесцентных примесей.
-Рефрактометрический детектор. Отслеживает изменение показателя преломления, поэтому видит всё, но плохо. Плюсы - дешевизна, универсальность. Минусы - очень низкая чувствительность, особенно если вещество не содержит тяжелых атомов. Однако для ГПХ часто используют именно его ввиду неэффективности остальных.
-Масс-спектрометрический детектор. Плюсы - видит почти всё, высокая чувствительность, дает информацию о составе и даже строении. Обычно используют МС с ионизацией ESI - для обратной фазы, или CI/APCI/APPI - для нормальной фазы. Стоят такие детекторы обычно куда дороже хроматографа, и тут ещё вопрос - то ли ВЭЖХ с МС-приставкой, то ли МС с ВЭЖХ-приставкой. Часто хроматограф просто подключают к уже имеющемуся исследовательскому масс-спектрометру.
Если прибор рассчитан на препаративное разделение, то после детектора (или в обход) стоит коллектор фракций - прибор, который собирает в разные емкости порции раствора (элюата) на выходе из хроматографа. Далее фракции можно собрать, удалить растворитель и получить чистые вещества.
Коллектор фракций. Собирает фракции в пробирки.
ВЭЖХ прибор с фотометрическим детектором стоит от 1 млн. р. - в минимальной комплектации под аналитику. Препаративный хроматограф с фотометрическим детектором, коллектором и автосамплером стоит от 3 млн.р. МС-детектор (только сам детектор!) для хроматографа с неразрушающей ионизацией стоит от 4 млн.р. и выше.
Плюсы:
1)Универсальность. Веществ, которые можно растворить, куда больше чем тех, которые можно испарить, отсюда куда более широкий спектр анализируемых объектов.
2)Репрезентативность. Если вколол однородный раствор - можешь быть более-менее уверен, что все низкомолекулярные компоненты смеси рано или поздно выйдут, в отличие от ГХ, где из 20 компонентов 15 может сдохнуть на испарителе, а из оставшихся пяти - два умрут в колонке, один изомеризуется а один декарбоксилируется.
3)Инертность. При аккуратной работе ВЭЖХ-разделение переживают даже очень нежные вещества. При необходимости можно подобрать абсолютно инертные стационарные и подвижные фазы, разделение можно проводить без контакта с воздухом.
4)Вариабельность. Много параметров, доступных для изменения, и позволяющих решать самые разные задачи. Вплоть до того, что на одном приборе можно решать как аналитические, так и препаративные задачи.
5)Возможность препаративного разделения. В принципе, на ВЭЖХ можно делить даже килограммы. Но это уже за гранью добра и зла, а вот 200-300 мг выделить - легко!
Минусы:
1)Большая стоимость анализа, и ещё большая - препаративного разделения. Уходит элюент (при препаративном разделении - литрами), дороже пробоподготовка, расходка, дороже сам прибор. Колонки живут меньше. Выше требования по квалификации оператора - больше затраты на ЗП.
2)Намного больше варьируемых параметров, и их влияние на результат огромно. И не так очевидно, как для ГХ. Если необходимо выходить за пределы литературных методик - требуется высокая квалификация и большой опыт. Без них можно месяцами тыкать пальцем в небо, но так и не найти рабочих условий.
3)Приборы сложнее - легче накосячить и даже сломать его, или запороть колонку. Плюс, дороже обслуживание. Ну, и покупка отечественного, китайского или БУ прибора - русская рулетка. Только для технически подкованных и опытных юзеров.
4)Чувствительность на несколько порядков ниже, чем у ГХ. То есть, анализировать ppm-ы и тем более ppb уже не получится.
У нас стоит один прибор, в довольно скромной комплектации. Хочется приобрести прибор покруче, но пока нет возможности.
3)Колоночная хроматография низкого давления. Для простоты буду называть её флеш - разница между этими терминами невелика. Принцип разделения тот же, что и у ВЭЖХ, но давление ниже - от нескольких миллибар до 20 бар. Это исторически первый тип хроматографии, разработан А. Цветом больше века назад. С незначительными изменениями он широко используется в лабораторной практике до сих пор.
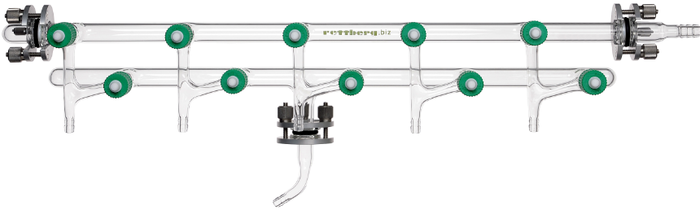
Вот так выглядят колонки для флеш. Стекло, тефлоновые краны.
В колонку вносится сорбент (обычно силикагель) - сухой или в виде суспензии, уплотняется постукиванием по внешней стенке, а потом поверх сорбента простой пипеткой или шприцем наносится раствор с разделяемой смесью. Раствору дают впитаться, и наливают сверху элюент. Элюент течет самотеком или под небольшим давлением. Фракции собирают, просто подставляя вниз пробирки или стаканы. Далее фракции анализируют по ТСХ.
Это реальная фотография моей колонки (справа). Тут удобно - вещества окрашены. Но обычно колонка просто белая.
В какой-то момент технический прогресс и ленивые химики объединились, чтобы автоматизировать этот довольно долгий и нудный процесс (обычно разделение идет 2-3 часа, и это не считая подготовки). Плодом этого союза стал флеш-хроматограф.
Тадам! А вот и он. Наиболее интересный для оргсинтетика хроматограф.
Принципиально схема та же, что и у ВЭЖХ. Но есть и отличия:
-Низкие давления, поэтому фитинги не из стали, а из полипропилена или фторопласта. колонки кстати, тоже или полипропилен, или стекло
-Колонки не термостатируют - влияние температуры ничтожно
-Очень производительный насос, может выдавать сотни миллилитров в минуту
-Ввод образца не через Rheodyne, а шприцом прямо в колонку. Обычно есть ещё опция десорбции с носителя - т.н. сухое нанесение
Колонки, кстати, часто перенабиваемые. Вручную. Что сильно удешевляет разделение. Вообще, колонки для флеш - разговор особый. С одной стороны, флеш не дает таких давлений, как ВЭЖХ, а значит и эффективность разделения куда меньше. Зато колонки под флеш могут быть любого размера - от карандаша до бочки. Такие колонки не таскают вручную - они стоят в стойках на колёсиках. И если разделение сотни грамм вещества в ВЭЖХ - это десятки или даже сотни вколов, несколько дней работы, то на флеше это можно поделить зараз. Причем не на самой большой колонке - вполне сойдет колонка размером с двухлировую бутылку. На колонке размером с бочку за один вкол можно поделить килограмм.
Использовать флеш-хроматограф в аналитических целях конечно можно, но не нужно. Он создавался для препаративного разделения. Поэтому плюсы и минусы расписывать не буду - они аналогичны ВЭЖХ, только дешевле и ниже эффективность разделения.
Стоит такой прибор от 1 млн.р. до 5 млн.р. в полном фарше. Есть ещё высокопроизводительные системы, системы "флеш-ВЭЖХ", которые могут и то, и то, а также системы с МС-детектором. Они могут стоить и 10 млн.р.
У нас есть один прибор. Новый и в приличном фарше. Я им не очень доволен по ряду причин, но дареному коню в зубы не смотрят...
Итак, сегодня мы закончили говорить об оборудовании, которое +- обеспеченная лаборатория, занимающаяся органическим синтезом, может и хочет приобрести себе в единоличное пользование. У меня в загашнике есть ещё две темы. Первая - это дорогие и большие приборы, которое обычно покупаются на весь институт или в складчину на несколько научных групп. В основном это спектроскопия, но не только. Вторая тема - стекло для органического синтеза. Вот тут можно составить более-менее адекватную смету и понять, сколько нужно закупить стекла, чтобы четверо синтетиков работали, не испытывая дискомфорта. Писать про реактивы я не хочу - тут нет какого-то общего ассортимента, всё сугубо индивидуально.
На сегодня всё!
Баянометр выдаёт какую-то фигню. Комменты для минусов внизу.
З.Ы. У меня нежданно-негаданно набралось аж 55 подписчиков! Не ожидал, что эта тема будет настолько интересна. Специально для подписчиков - если вы хотите узнать что-то про работу химика-синтетика - пишите, постараюсь удовлетворить ваше любопытство комментарием или даже постом...